Методика поверки «Модули измерительные CFX96 в составе термоциклеров для амплификации нуклеиновых кислот C1000 Touch» (Код не указан!)
УТВЕРЖДАЮ

рТс Заместитель директора ФГУП «ВНИИМС» рной метрологии
Н.В. Иванникова
2018 г.
Модули измерительные CFX96 в составе термоциклеров для амплификации нуклеиновых кислот С1000 Touch
Методика поверки
с Изменением № 1
Москва 2018
1. ВВЕДЕНИЕНастоящая методика распространяется на Модули измерительные CFX96 в составе термоциклеров для амплификации нуклеиновых кислот С1000 Touch (далее-модули), изготавливаемые «Bio-Rad Laboratories, Inc.», США на заводе «Bio-Rad Laboratories (Singapore) Pte. Ltd.», Сингапур и устанавливает методику их первичной и периодической поверки.
Интервал между поверками - 1 год.
Действие документа распространяется на средства измерений, находящиеся в эксплуатации.
2. ОПЕРАЦИИ ПОВЕРКИ-
2.1. При проведении поверки выполняют операции, приведенные в таблице 1.
Таблица 1
|
Наименование операции |
Номер пункта методики поверки |
|
Внешний осмотр |
7.1 |
|
Опробование |
7.2 |
|
Определение метрологических характеристик |
7.3 |
3. СРЕДСТВА ПОВЕРКИ
-
3.1. При проведении поверки применяют следующие основные средства поверки: Стандартный образец фрагмента плазмиды pUC 18 длиной 271 нуклеотид
ГСО 9931-2011, массовая концентрация ДНК в водном растворе - 49,1 нг/мкл, пределы относительной погрешности 10,7 % (при Р=0,95).
Вспомогательные средства:
-
1. Центрифуга, предназначенная для работы с 96-луночными микропланшетами фирмы Eppendorf
-
2. Шейкер типа Vortex
-
3. Дозаторы с переменным объёмом дозирования по ТУ 9452-002-33189998-2002 или аналогичные:
(2- 20) мм3 с шагом 0,01 мм3, с точностью ±0,8%;
(20- 200) мм3 с шагом 0,1 мм3, с точностью ±0,6%;
(100 - 1000) мм3 с шагом 1 мм3, с точностью ±3 %.
-
4. Наконечники пластиковые с фильтром объемом (2-20) мм'
Наконечники пластиковые с фильтром объемом (1-200) мм'
Наконечники пластиковые с фильтром объемом (200-1000) мм '
Наконечники пластиковые без фильтра объемом (1-10) мм3
-
5. Пробирки пластиковые типа Eppendorf объемом 1.7 мл. фирмы SSI для приготовления реакционной смеси
-
6. Низкопрофильные 0,2 мл стрипы по 8 пробирок или плашки на 96 лунок для проведения ПЦР в режиме реального времени фирмы Bio-Rad
Реагенты:
2х SsoAdvanced™ SYBR* Green Supermix- 2x- буфер для проведения ПЦР в режиме реального времени в присутствии интеркалируюшего красителя SYBR Green 1 фирмы Bio-Rad
-
1. Праймеры F 5'- AAGGAGAAAATACCGCATCA-3'
R 5 ’ - AACCCTGGCGTTАССС -3 *
-
2. Стандартный образец
-
3. Деионизированная вода качества MQ
Примечания
Допускается использование лабораторного оборудования и реагентов других производителей, по метрологическим и техническим характеристикам, не уступающим перечисленным выше.
-
3.2. При поверке результаты измерений считываются с ЖКИ дисплея поверяемого модуля или подключенного компьютера.
-
3.3. Вместо стандартного образца фрагмента плазмиды pUC18 длиной 271 нуклеотид ГСО 9931-2011 допускается применение государственного стандартного образца № 9866-2011 состава ДНК сои (комплект ГМ-СОЯ-ВНИИМ). Нормированная метрологическая характеристика ГСО - массовая доля ДНК генетически модифицированной сои линии 40-3-2 в ДНК натуральной сои с границами относительной погрешности (при Р = 0,95) ± 12 %. В этом случае в качестве реагентов необходимо использовать набор для идентификации линии (трансформационного события) GTS 40-3-2 генетически модифицированной (ГМ) сои в продуктах питания, пищевом сырье, семенах и кормах для животных методом полимеразной цепной реакции в реальном времени (ПЦР-РВ) «Соя GTS 40-3-2 идентификация» по ГОСТ Р 57175-2016.
-
3.4. Вода деионизированная, ГОСТ Р 52501-2005.
-
3.5. Вспомогательные средства при проведении поверки с использованием государственного стандартного образца № 9866-2011 состава Д1IK сои (комплект ГМ-СОЯ-ВНИИМ):
-дозаторы пипеточные по ГОСТ 28311-89 одноканальные с варьируемым объемом дозирования
(2 - 20) мм3 с шагом 0,01 мм3, с точностью ±0,8%;
(20 - 200) мм3 с шагом 0,1 мм3, ±0,6%;
(100 - 1000) мм3 с шагом 1 мм3, ±3 %;
-ПЦР плашки на 96 лунок, стрипы 0,2 мл, пробирки 0,2 мл, штатив для микропробирок 0,2 мл;
- пластиковые полипропиленовые или стеклянные пробирки объемом не менее 1,5 мл; -центрифуга-вортекс Микроспин FV-2400 или аналогичная.
Примечание: Допускается применение аналогичных средств поверки, обеспечивающих определение метрологических характеристик поверяемых СИ с требуемой точностью.
4. ТРЕБОВАНИЯ БЕЗОПАСНОСТИ-
4.1. При проведении поверки соблюдают требования безопасности, определяемые:
-
- правилами безопасности груда и пожарной безопасности, действующими на предприятии;
-
- правилами безопасности при эксплуатации используемых эталонных средств измерений, испытательного оборудования и поверяемого прибора, приведенными в эксплуатационной документации.
-
4.2. Проведению испытаний и обработке их результатов допускают специалистов, имеющих высшее или специальное биологическое образование, опыт работы в данной области не менее 3 лет, прошедших обучение и владеющих техникой проведения соответствующих йеныта!iий
-
4.3. При работе со СО избегать попадания на слизистые оболочки. При попадании промыть чистой водой. При работе использовать резиновые перчатки.
-
4.4. Перед применением следует проверить целостность упаковки и срок годности
СО.
4.5 При работе с реактивами соблюдают требования безопасности, установленные для работы с токсичными, едкими и легковоспламеняющимися веществами по ГОСТ 12.1.007-76, ГОСТ 12.1.005-88.
-
4.6. Помещение лаборатории должно быть оборудовано приточно-вытяжной вентиляцией. Содержание вредных веществ в воздухе рабочей зоны не должно превышать ПДК (ОБУВ), установленных ГН 2.2.51313-03 и ГН 2.2.5.2308-07.
-
5.1. При проведении поверки соблюдают следующие условия:
-температура окружающего воздуха, °C 20±5
-температура контролируемо среды, °C 2О±5
-атмосферное давление, кПа 86 + 107
-напряжение питания переменного тока, В от 200 до 240
-относительная влажность, % от 30 до 80
6. ПОДГОТОВКА К ПОВЕРКЕ-
6.1. Перед проведением поверки выполняют следующие подготовительные работы:
-
6.1.1 Технология приготовления реакционной смеси
При приготовлении реакционной смеси рекомендуются следующие объемы
компонентов в расчете на 1 пробирку/реакцию:
|
Компонент |
Объем на 1 пробирку/реакцию |
|
2х SsoAdvanced™ SYBRr Green Supermix |
12,5 мкл |
|
Праймер F (20 пкмолей/мкл) |
0.25 мкл |
|
Праймер R (20 пкмолей/мкл) |
0,25 мкл |
|
Деионизованная вода |
До 25 мкл |
|
Образец ДНК * |
5 мкл |
*Используют 5-кратное разведение ДНК.
-
6.1.2. Все компоненты реакционной смеси смешивают в одной пробирке и разливают по 20 мкл в низкопрофильные 0,2 мл стрипы или плашки на 96 лунок для проведения ПЦР в режиме реального времени, после чего добавляют по 5 мкл предварительно разведенного в 5 раз образца ДНК.
-
6.2. Приготовление рабочих концентраций
Для построения стандартной кривой используют следующие рабочие концентрации стандартного образца (число молекул в мкл раствора) - 2x101 - стандарт 1 (Std-1), 101 стандарт 2 (Std-2), 2x1016 - стандарт 3 (Std-3), 1016 - стандарт 4 (Std-4), 2xlO15 - стандарт 5 (Std-5), IO15 - стандарт 6 (Std-6) , 2х 1014 - стандарт 7 (Std-7), 1014 - стандарт 8 (Std-8), 2x IO13 -стандарт 9 (Std-9) и IO1, - стандарт 10 (Std-10).
Для этого стандартный образец последовательно разводят в деионизированной воде. Перед разведением образец встряхнуть на вортексе.
Примечание:
Допускается использование любых других концентраций стандартного образца, лежащих в предложенном выше интервале. Для каждого нового разведения использовать новый наконечник.
6. 3. Приготовление анализируемого образца
Для приготовления анализируемого образца (Unk) стандартный образец разводят до любой молярной концентрации, лежащей в диапазоне значений, предложенном выше.
6.4 При закладке планшета рекомендуются следующие компоненты:
-
1. Приготовленные разведения стандартного образца с известной молекулярной концентрацией.
-
2. Анализируемый образец.
-
3. Отрицательный контроль. В качестве отрицательного контроля используют реакционную смесь, в которую вместо ДПК-матрицы добавляют такой же объем деионизированной воды.
Изменение 1: При использовании в качестве основного средства поверки ГСО № 9866-2011 состава ДНК сои (комплект ГМ-СОЯ-ВНИИМ):
-
6.5. Подготовить прибор к работе в соответствии с требованиями руководства по эксплуатации
-
6.6. Подготовить наборы реагентов в соответствии с их инструкциями по применению.
-
- 6.7. Подготовить пробирку (1,5 мл или более) для приготовления реакционного раствора;
-
- 6.8. Подготовить и подписать 3 микропробирки (0,5 мл или более) для приготовления разбавлений (К2, КЗ и К4);
-
- подготовить ПЦР-плашку на 96 лунок или 6 ПЦР-стрипов 0,2 мл или 34 ПЦР-пробирки 0,2 мл.*
* Количество стрипов или пробирок указано исходя из 6-кратного дублирования для каждого из 4-х контрольных растворов и одного исследуемого образца и 4-х кратного дублирования для отрицательного контрольного образца, рекомендуется использовать
низкопрофильный пластик
Допускается другое число повторных разведений, но не менее 3-х для каждою из разбавлений и образцов.
-
6.9. Реакционный раствор.
Для приготовления реакционного раствора используется набор реагентов «Соя GTS 40-3-2 идентификация». Суммарный минимально необходимый объем реакционного раствора рассчитывается по следующей формуле:
21x(N+l) мкл реакционной смеси «Соя GTS 40-3-2» + 0.5x(N+l) мкл Taq ДНК-полимеразы. где N - количество исследуемых проб (число реакций).
Для одной реакции используется 20 мкл реакционного раствора.
-
6.10. Приготовление реакционного раствора:
-
6.10.1. Разморозить пробирки с реакционной смесью «Соя GTS 40-3-2», выдержать 15 минут при комнатной температуре, перемешать на центрифуге-вортексе и центрифугировать в течение нескольких секунд для сброса капель.
-
6.10.2. В отдельной чистой пробирке подходящего размера (1,5 мл или более) смешать 735 мкл реакционной смеси «Соя GTS 40-3-2» и 17,5 мкл SynTaq ДНК-полимеразы.
-
6.10.3. Полученный раствор перемешать на центрифуге-вортексе и центрифугировать в течение нескольких секунд.
Примечание. Данные объемы указаны исходя из 6-кратного дублирования для каждого из 4-х контрольных растворов и одного исследуемого образца и 4-крагного дублирования для отрицательного контрольного образца (всего 34 реакции).
-
6.11. Контрольные растворы.
Для приготовления контрольных растворов используется ГСО «ГМ-СОЯ-ВНИИМ-5» и его последовательные разведения в деионизированной воде. Для построения калибровочных кривых используются следующие контрольные растворы:
Таблица 2.
|
Описание |
Число молекул в 5 мкл, условно | ||
|
Натур. Соя |
ГМ соя | ||
|
К1 |
«ГМ-СОЯ-ВНИИМ-5» |
1000 |
50 |
|
К2 |
«ГМ-СОЯ-ВНИИМ-5», разведенный водой в пропорции 1:2 (в 3 раза) |
333 |
16,7 |
|
КЗ |
К2, разведенный водой в пропорции 1:2 (в 3 раза) |
111 |
5,56 |
|
К4 |
КЗ, разведенный водой в пропорции 1:2 (в 3 раза) |
37 |
1,85 |
-
6.12. Приготовление контрольных растворов:
-
6.12.1. Разморозить пробирку ГСО № 9866-2011 «ГМ-СОЯ-BI1ИИМ-5», выдержать 15 минут при комнатной температуре, перемешать на центрифуге-вортекее и центрифугировать в течение нескольких секунд для сброса капель.
6.12.2.11одготовить 3 чистые пробирки подходящего размера для приготовления разбавлений ГСО «ГМ-СОЯ-ВНИИМ-5» (Пробирки обозначим, как К2, КЗ и К4).
-
6.12.3. В пробирке К2 смешать 16 мкл ГСО «ГМ-СОЯ-ВПИИМ-5» и 32 мкл деионизированной воды, полученный раствор перемешать па центрифуге-вортекее и центрифугировать в течение нескольких секунд.
-
6.12.4. В пробирке КЗ смешать 16 мкл раствора из пробирки К2 и 32 мкл деионизированной воды, полученный раствор перемешать на центрифуге-вортекее и центрифугировать в течение нескольких секунд.
-
6.12.5. В пробирке К4 смешать 16 мкл раствора из пробирки КЗ и 32 мкл деионизированной воды, полученный раствор перемешать на центрифуге-вортекее и центрифугировать в течение нескольких секунд.
Примечание. Данные объемы указаны исходя из 6-кратного дублирования для каждого из 4-х реакционных растворов.
-
6.13. Подготовка отрицательного контроля и исследуемого образца:
-
6.13.1. Разморозить пробирку отрицательного контрольного образца (ОКО) из набора «Соя GTS 40-3-2 идентификация», выдержать 15 минут при комнатной температуре, перемешать на центрифуге-вортекее и центрифугировать в течение нескольких секунд для сброса капель.
-
6.13.2. Разморозить пробирку ГСО № 9866-2011 «ГМ-СОЯ-ВНИИМ-1» (С1, исследуемый образец), выдержать 15 минут при комнатной температуре, перемешать на центрифуге-вортекее и центрифугировать в течение нескольких секунд для сброса капель.
-
7.1. Внешний осмотр
При внешнем осмотре проверяют:
-отсутствие механических повреждений на модуле, препятствующих его применению или нормальной работе;
-соответствие информации на табличке модуля требованиям эксплуатационной документации;
-соответствие комплектности модуля указанной в документации.
Модуль, не прошедший внешний осмотр к поверке не допускают.
-
7.2. Опробование
-
- программное обеспечение идентифицируется путем вывода номера версии программного обеспечение по запросу пользователя через меню программ;
-
- в каналах, загруженных деионизированной водой, отображается нулевая концентрация.
-
7.3. Определение метрологических характеристик.
-
7.3.1 Задают следующий протокол испытаний:
-
1. Шаг№1 95°С 30 сек
-
2. Шаг № 2 95°С 5 сек
-
3. Шаг№3 60 °C 20 сек
Переход на шаг № 2 (35-40 повторов).
-
7.3.2 Определение диапазона измерений
производится с помощью градуировочной кривой.
Модуль считается выдержавшим поверку, если диапазон измерений от 101' молекул в мкл раствора до 1018 молекул в мкл раствора/
-
7.3.3 Определение погрешности измерений
Относительная погрешность определения концентрации СО фрагмента плазмиды pUC 18 длиной 271 нуклеотид:
г> = —---юо%SQMean
где SQMean -среднее значение концентрации анализируемого образца, определяемое
модулем
Д-границы погрешности оценки измеряемой величины, определяемое по формуле:
Д = 1,11-71,04-10”+(50^ )2
SQstdDev - стандартное отклонение концентрации анализируемого образца, определяемое модулем.
Модуль считается выдержавшим поверку, если значение относительной погрешности определения концентрации СО фрагмента плазмиды pUC18 длиной 271 нуклеотид не превышает 34 %.
Изменение 1: 7.4 Проверка идентификационных данных программного обеспечения
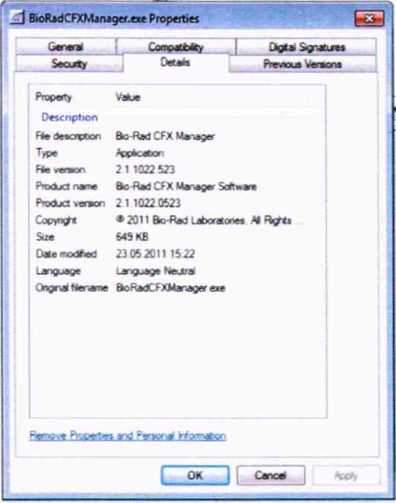
Идентификационные сведения о отображаются на вкладке «Details»:
CFX Manager 2.1
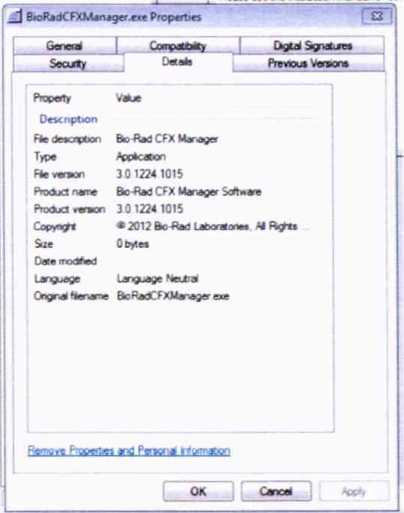
CFX Manager 3.0
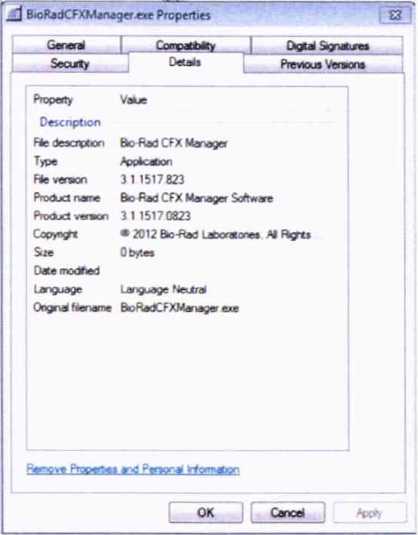
CFX Manager 3.1
CFX Maestro 1.0
BioRadCFXMansger.exe Properties
General | Ccwpatfy | Seorty D«a*» Previous versions
|
Property |
Value |
|
Description | |
|
File ОеэслрЬоп |
bo-Rad CFX Maestro |
|
Type |
Application |
|
Ale version |
4 0 2325418 |
|
Product name |
Bo-Rad CFX Maestro Software |
|
Product verswn |
4 0 2325 0418 |
|
Copyngtt |
* 2017 Bo Rad Laboratories Al Rigrts |
|
ire |
0 bytes |
|
Date modrfed | |
|
Language |
Language Neutral |
|
OngnalWename |
BoRadCFXManager e»e |
Remove Properties and Persona Иогтдюг
OK Cancel -cx>
Bio-Rad CFX Maestro 1.1
(Г BioRadCFXManager.exe Properties S3
General CompatWty | Securty taafe Prewoua Verawns
|
Property |
Value |
|
Description | |
|
Fie descriptor! |
60 Rad CFX Maestro |
|
Type |
Appkcatwn |
|
Fie verawn |
4 1 2423 1219 |
|
Product name |
Bw Rae CFX Maestro Software |
|
Product verwon |
4 1 2433 1219 |
|
Copyright |
* 2017 So Rad laboratories Ai Rights |
|
Sae |
0 bytes |
|
Datemodfeo | |
|
Language |
Language Neutral |
|
Ongnatfiename |
boRadCFXManager еже |
Remove Properties ana Peraonal Horm^wn
OK Cancer
Рис.1 Окнас названием и номером версии ПО
7.4.2 Проверка контрольной суммы файла BioRadCFXManager.exe осуществляется по алгоритму MD5.
Для расчета контрольной суммы используется программа HashTab версии 6.0.0 или выше, или аналогичная.
При использовании программы HashTab порядок действий следующий:
в папке, в которой находятся файлы программы, найти файл BioRadCFXManager.exe и установить на него курсор;
нажать правую кнопку мыши и выбрать пункт «свойства»;
в открывшемся окне выбрать закладку «File Hashes», в которой выбрать строку MD5;
из указанной строки считать значение хеш-суммы (цифрового идентификатора ПО).
Совпадение идентификационных данных запущенного ПО с данными, приведенными в таблице 6 является положительным результатом проверки идентификационных данных ПО.
Таблица 3 - Идентификационные данные программного обеспечения
|
Идентификационные данные (признаки) |
Значение | ||||
|
Идентификационное наименование программного обеспечения |
Bio-Rad CFX Manager Softwar е |
Bio-Rad CFX Manager Software |
Bio-Rad CFX Manager Software |
Bio-Rad CFX Maestro Software |
Bio-Rad CFX Maestro Software |
|
Номер версии (идентификационный номер) |
2.1 |
3.0 |
3.1 |
4.0 |
He ниже 4.1 |
|
Цифровой идентификатор ПО |
E8FCF9 BB13D В95148 C9BAF 8210D0 F6E1 |
45378A155 3AFCCE41 FBDF7DE FDE8C4A 9 |
92EC0119 418269654 E03F4A1B 856A40F |
AB3BC93 EC7FFDD 4A7B1F39 BFA262A EB3 |
AB3BC9 3EC7FFD D4A7B1F 39BFA26 2 |
|
Алгоритм вычисления цифрового идентификатора ПО |
MD5 |
MD5 |
MD5 |
MD5 |
MD5 |
7.5. Определение метрологических характеристик при использовании в качестве основного средства поверки ГСО № 9866-2011 состава ДНК сои (комплект ГМ-СОЯ-ВНИИМ):
-
7.5.1. В каждую анализируемую лунку ПЦР-плашки (пробирку/лунку стрипа) внести
20 мкл реакционного раствора и 5 мкл образца/конгрольного раствора/отринательного контроля.
-
7.5.2. Исследуемую плашку (пробирки/стрипы) плотно закрыть, центрифугировать
для сброса капель и установить в реакционный модуль прибора. Записать и сохранить информацию о позициях проб в реакционном модуле.
-
7.5.3. Запрограммировать прибор для выполнения соответствующей программы амплификации и детектирования флуоресцентного сигнала и провести ПЦР-реакцию в режиме реального времени:
В меню File выбрать New—^Protocol. В появившемся окне задать циклограмму со
следующими параметрами: Sample Volume 25 pl 1.95,0 С for 5:00
-
2. 95,0 С for 0:15
-
3. 59.0 С for 0:40
+Plate read
-
4. GOTO 2, 49
END
Нажать ОК и сохранить протокол на компьютере в удобной рабочей папке.
-
7.5.4. Внести сведения об образцах и красителях. Для этого во вкладке Plate выбрать опцию Create New. Нажать кнопку Select Fluorophores. В появившемся окне выбрать красители HEX, ROX. Нажать ОК. Обозначить на плашке месторасположение образцов (рекомендуемое расположение образцов в лунках показано на рисунке 1):
1
2
3
4
5
6
7
8
9
10
11
12
А
С1
К1
К2
КЗ
К4
В
С1
К1
К2
КЗ
К4
С
С1
К1
К2
КЗ
К4
ОКО
D
С1
К1
К2
КЗ
К4
ОКО
Е
С1
К1
К2
КЗ
К4
око
F
С1
К1
К2
КЗ
К4
око
G
Н
Рисунок 2. Рекомендуемое расположение образцов.
-
7.5.5.Выделить лунки, в которых находятся пробирки с первым контрольным раствором (К1), и в графе Sample Туре выбрать строчку Standard. Задать измерение сигнала по выбранным красителям, поставив галочки в колонке Load напротив названий всех выбранных в п.6 красителей. Задать номер стандарта, выбрав 1 в графе Replicate # и поставив галочку в колонке Load напротив данной графы. В графе Concentration выбрать <НЕХ>, ввести условное число молекул ДНК 1000. В графе Concentration выбрать <ROX>, ввести 50.
7.5.6 Повторить то же самое для контрольных растворов К2, КЗ и К4, вводя условное число молекул ДНК согласно таблице ниже. (В графе Replicate # выбирать, соответственно, 2, 3 и 4).
Таблица 4
|
Наименование |
Условное число молекул ДНК (Concentration) | ||
|
в методике |
в НО CFX |
HEX (Соя вся) |
ROX (Соя ГМ) |
|
К1 |
Std-1 |
1000 |
50 |
|
К2 |
Std-2 |
333 |
16.7 |
|
КЗ |
Std-3 |
111 |
5.56 |
|
К4 |
Std-4 |
37 |
1.85 |
|
С1 |
Unk-1 |
- |
- |
|
ОКО |
NTC |
- |
- |
-
7.5.7. Выделить лунки, в которых находятся пробирки с ОКО, в графе Sample Туре выбрать NTC. Задать измерение сигнала по выбранным красителям, поставив галочки в колонке Load напротив названий всех выбранных в п.6 красителей. Задать номер контроля, выбрав 1 в графе Replicate # и поставив галочку в колонке Load напротив данной графы.
-
7.5.8. Выделить лунки, в которых находятся пробирки с неизвестным образцом С1, в графе Sample Туре выбрать Unknown. Задать измерение сигнала по выбранным красителям, поставив галочки в колонке Load напротив названий всех выбранных в и.6 красителей. Задать номер образца, выбрав 1 в графе Replicate # и поставив галочку в колонке Load напротив данной графы.
-
7.5.9. Нажать ОК. Дать имя плашке с указанием даты эксперимента и сохранить полученный файл на компьютере в удобной рабочей папке.
-
7.5.10. Начать работу прибора. Для этого выбрать закладку Start Run, в которой нажать клавишу Start Run. Задать имя будущего файла результатов с указанием даты проведения эксперимента. Сохранить файл на компьютере в удобной рабочей папке.
Зафиксировать в рабочем журнале название файла. После завершения амплификации провести обработку и сохранение данных.
7.5.11. Обработка результатов анализаПосле завершения амплификации программа «CFX Manager Software » («CFX Maestro Software ») откроет окно “Data Analysis”. Открыть данное окно также можно, выбрав в основном меню программы File—>Open—>Data File... и указав необходимый файл результатов.
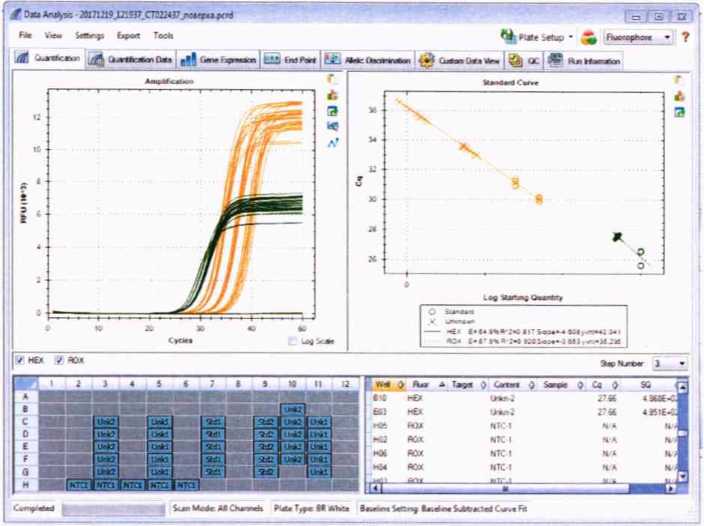
Установить расчет результатов анализа методом Regression. Для этого в меню Settings выбрать Cq Determination Mode—^Regression.
-
7.5.12. Убедиться, что результаты анализа подлежат учету
Результаты анализа не подлежат учету:
-
- в случае регистрации роста сигнала NTC по каналу HEX и/или ROX (ложноположительный результат всего эксперимента);
-
- в случае регистрации роста сигнала в пробирке с исследуемым образцом по каналу ROX одновременно с отсутствием роста сигнала по каналу HEX (ложноположительный результат в конкретной пробирке);
-
- в случае отсутствия регистрации роста сигнала в пробирке с исследуемым образцом по каналу HEX (ложноотрицательный результат в конкретной пробирке);
-
- в случае отсутствия роста сигнала Std-n по каналам HEX и/или ROX (ложноотрицательный результат всего эксперимента).
Результаты анализа подлежат учету:
-
- в случае регистрации роста сигнала в пробирках с исследуемым образцом по каналу HEX;
-
- в случае отсутствия роста сигнала флуоресценции NTC по каналам HEX и ROX;
-
- в случае регистрации роста сигнала Std-i по каналам HEX, ROX одновременно.
-
- Примечание. В случае если результаты анализа не подлежат учету (Приложение 2, п.1) следует повторить постановку ПЦР, обращая внимание на тщательное приготовление растворов. По возможности, использовать набор «Соя GTS 40-3-2 идентификация» из другой партии.
-
7.5.13. Убедится, что коэффициенты корелляции калибровочных графиков (величины RA2 на панели Standard Curve) составляют не менее 0,95.
Примечание. Допускается исключение из анализа некоторых лунок при условии, что число повторов данного образца, учитываемых при анализе, будет не менее 3-х.
Чтобы исключить ячейку из анализа необходимо щелкнуть правой кнопкой мыши по исключаемой ячейке и в появившемся меню выбрать Weil Хх—^Exclude from Analysis.
-
7.5.14. В окне “Data Analysis” открыть закладку “Quantification Data”. Щелкнув правой кнопкой мыши по таблице результатов (“Results”), выбрать “Sort...”. В появившемся окне выбрать Sort by: Content и Then by: Fluor. Нажать “OK”.
Щелкнув правой кнопкой мыши по таблице результатов (“Results”), выбрать “Select Columns...”, В появившемся окне выбрать только Fluor, Content и SQ Mean (Starting Quantity Mean - среднее значение исходной концентрации ДНК). Нажать “ОК”.
,f 0.U - J017U19.1215P.CT0Z24I7.no.^.j perd
Fd« SOnp Ieoh PUf» SMup • jp Fsuo«opho« «| ?
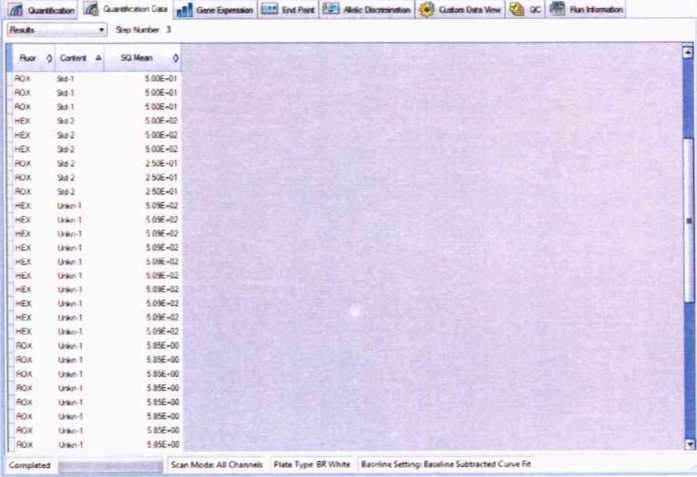
Для Unkn-1 записать значения SQ Mean для каналов ROX и HEX.
Примечание. Запись ”Е±хх" в таблице результатов означает ”10 в степени ±хх”,
например 5.85Е+ОО = 5,85.
-
7.5.15. Сохранить отчет о результатах анализа (в формате PDF). Для этого в окне “Data Analysis” выбрать Tools—»Reports... , File—>Save.
Примечание. Сохранить результаты анализа в распространенных форматах можно, воспользовавшись функцией экспорта (“Export”) программного обеспечения " CFX Manager Software /Maestro Software ”.
-
7.5.16. Провести расчет измеренной массовой доли ДНК генетически модифицированной сои линии 40-3-2 в ДНК натуральной сои в ГСО «ГМ-СОЯ-ВНИИМ-1» (исследуемый образец, Unkn-1, Cl) по формуле
г г *1 SQMean^ROX)
К' — = 1000 х —---------.
кзм W SQMecin(HEX)
Относительная погрешность измерений массовой доли ДНК генетически модифицированной сои линии 40-3-2 в ДНК натуральной сои в ГСО «ГМ-СОЯ-ВНИИМ-1» рассчитывается по формуле
<5[%] = ~ Л'еп.и1 х 1()0%
^спец
где КСпец - аттестованное значение массовой доли ДНК генетически модифицированной сои линии 40-3-2 в ДНК натуральной сои в ГСО «ГМ-СОЯ-ВНИИМ-1»
Прибор считается прошедшим поверку, если относительная погрешность определения массовой доли ДНК генетически модифицированной сои линии 40-3-2 в ДНК натуральной сои в образце «ГМ-СОЯ-ВНИИМ-1» не превышает 30 %».
8. ОФОРМЛЕНИЕ РЕЗУЛЬТАТОВ ПРОВЕРКИ-
8.1. Результаты поверки оформляют протоколом.
-
8.2. При положительных результатах поверки делают отметку в паспорте в соответствии с ПР50.2.006.
-
8.3. При отрицательных результатах поверки модули к эксплуатации не допускают, отметку в паспорте аннулируют и выдают извещение о непригодности с указанием причин в соответствии с ПР 50.2.006.
Изменение 1: Заменить п. 8.1-8.3 следующими
«8.1 Положительные результаты поверки оформляют выдачей свидетельства по форме, установленной приказом Минпромторга РФ № 1815 от 02.07.2015.
-
8.2 Модули, не удовлетворяющие требованиям настоящих рекомендаций, к эксплуатации не допускаются. Модули изымают из обращения. Свидетельство о поверке
изымают и выдают извещение о непригодности.
-
8.3 После ремонта средства измерений подвергают поверке.
-
8.4 Знак поверки наносится на свидетельство о поверке».

Е.В. Кулябина
О.Н. Мелкова
Начальник лаборатории 009
Ведущий инженер
18


