Методика поверки «ГСИ. Приборы для проведения полимеразной цепной реакции в режиме реального времени Rotor-Gene Q» (МП-209-038-2017)
Федеральное государственное унитарное предприятие «Всероссийский научно-исследовательский институт метрологии имени Д.И. Менделеева» ФГУП «ВНИИМ им. Д.И. Менделеева»
УТВЕРЖДАЮ директора
ФГУП

Пронин 2017 г.
Государственная система обеспечения единства измерений
Приборы для проведения полимеразной цепной реакции в режиме реального времени Rotor-Gene Q
Методика поверки МП-209-038-2017
Руководитель лаборатории
___________В.И. Суворов
Разработчик:
Инженер II категории

М.С. Мамцева
г. Санкт-Петербург 2017 г.
Настоящая методика распространяется на приборы для проведения полимеразной цепной реакции в режиме реального времени Rotor-Gene Q предназначенные для измерений содержания фрагментов целевой дезоксирибонуклеиновой кислоты (ДНК) - конечного продукта полимеразной цепной реакции (ПЦР) - в ДНК исследуемого образца.
Приборы подлежат первичной и периодической поверке.
Интервал между поверками - 1 год.
1 Операции поверкиОбъем и последовательность операций поверки указаны в таблице 1.
Таблица 1
|
Наименование операции |
Номер пункта, в котором изложена методика поверки |
Обязательность проведения операции | |
|
При первичной поверке |
При периодической поверке | ||
|
1. Внешний осмотр |
п. 6.1 |
Да |
Да |
|
2. Опробование |
п. 6.2 |
Да |
Да |
|
3. Подтверждение соответствия программного обеспечения |
п. 6.3 |
Да |
Да |
|
4. Определение метрологических характеристик: | |||
|
4.1. Определение относительной погрешности и относительного СКО случайной составляющей погрешности при измерении массовой доли ГМО сои методом ПЦР |
п. 6.4-6.5 |
Да |
Да |
При получении отрицательных результатов при проведении той или иной операции дальнейшая поверка прекращается.
2 Средства поверки-
2.1 При проведении поверки применяются средства измерений и оборудование, представленное в таблице 2.
2.3 Все средства поверки должны иметь действующие свидетельства о поверке, все ГСО должны иметь действующие паспорта.
2 Требования безопасности
При проведении поверки должны быть соблюдены требования безопасности:
-
- К работе с приборами, используемыми при поверке, допускаются лица, прошедшие инструктаж по технике безопасности при работе с электроприборами.
-
- К работе с СО допускается персонал прошедший специальный инструктаж и имеющий опыт проведения ПЦР.
-
- Перед включением должен быть проведен внешний осмотр приборов с целью определения исправности и электрической безопасности включения их в сеть.
-
- Для получения данных по поверке допускается участие операторов, обслуживающих прибор (под контролем поверителя).
-
- При удалении отходов после амплификации (пробирок, содержащих продукты ПЦР) недопустимо открывание пробирок и разбрызгивание содержимого, в целях предотвращения контаминации продуктами ПЦР лабораторной зоны, оборудования и реагентов.
-
- При работе с СО необходимо использовать одноразовые перчатки, которые подлежат смене при каждой новой операции. Работа без перчаток не допускается на всех этапах постановки ПЦР.
-
Таблица 2
|
Наименование |
Характеристики |
|
Стандартные образцы | |
|
ГСО 9866-2011 состава ДНК сои (КОМПЛЕКТ ГМ-СОЯ-ВНИИМ). Нормированная метрологическая характеристика ГСО - массовая доля ДНК генетически модифицированной сои линии 40-3-2 в ДНК натуральной сои с границами относительной погрешности (при Р=0,95) ± 12 % |
ГСО 9866-2011 |
|
Средства измерений и вспомогательное оборудование | |
|
Дозатор механический 1-канальный с варьируемым объемом дозирования 2,0.. .20,0 мкл фирмы «BIOHIT OYJ» (Рег.№ 43133-09) |
Рег.№ 43133-09 Диапазон объемов дозирования, мкл: 2,0-20,0 |
|
Дозатор механический 1-канальный с варьируемым объемом дозирования 0,5...10,0 мкл фирмы «BIOHIT OYJ» (Рег.№ 43133-09) |
Рег.№ 43133-09 Диапазон объемов дозирования, мкл: 0,5- 10,0 |
|
Дозатор механический 1-канальный с варьируемым объемом дозирования 10,0... 100,0 мкл фирмы «BIOHIT OYJ» (Рег.№ 43133-09) |
Рег.№ 43133-09 Диапазон объемов дозирования, мкл: 10,0-100,0 |
|
Набор для проведения полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) «АмплиКвант ГМ соя-FL» |
в составе: ПЦР-смесь-1-FRT ГМ соя, ПЦР-буфер-Flu, Полимераза (TaqF), ПКО ГМ соя 1 %, ТЕ-буфер, ОКО |
|
Микроцентрифуга-вортекс «Микроспин» FV- 2400 |
2400 об/мин |
|
ПЦР-бокс (защитная камера с УФ-лампой) настольный с рециркуляцией воздуха UVT-S-AR |
- |
|
Вода деионизованная |
ИСО 3694-77 (ОСТ 11.029.003) |
|
Тонкостенные пробирки для ПЦР |
объемом 0,2 мл и 0,5 мл |
2.2 Допускается применять средства, не приведенные в перечне, но обеспечивающие определение метрологических характеристик с требуемой точностью.
4 Условия поверки и подготовка к нейПри проведении поверки должны быть соблюдены следующие условия:
-
♦ температура окружающего воздуха: от 15 до 25 °C
-
♦ относительная влажность: до 80 %
-
♦ отклонение напряжения питания от номинального значения (220 ± 4.4) В
-
♦ атмосферное давление: от 84 до 106,7 кПа
Подготовить прибор к работе в соответствии с технической документацией фирмы-изготовителя.
При подготовке к поверке необходимо:
-
• осуществить прогрев прибора в соответствии с эксплуатационной документацией;
-
• проверить работоспособность прибора в режиме измерения.
Подготовить к работе прибора в соответствии с руководством по эксплуатации, рабочие эталоны и вспомогательные средства измерений согласно эксплуатационной документации на них. Перед проведением поверки анализатор необходимо откалибровать в соответствии с руководством по эксплуатации
6 Проведение поверки-
6.1 Внешний осмотр.
При проведении внешнего осмотра анализатор проверяется на соответствие следующим требованиям:
-
• отсутствие внешних повреждений, влияющих на точность показаний;
-
• отсутствие отсоединившихся или слабо закреплённых элементов схемы (определяется на слух при наклонах изделия).
-
• отсутствие механических повреждений;
-
• соответствие комплектности анализатора технической документации;
-
• исправность органов управления и настройки;
-
• четкость надписей на лицевой панели.
Прибор считается выдержавшим внешний осмотр, если он соответствует перечисленным выше требованиям.
Приборы с механическими повреждениями к поверке не допускаются.
-
6.2 Опробование.
При опробовании проверяется функционирование составных частей прибора согласно технической документации фирмы-изготовителя, а также возможность плавного регулирования показаний с помощью органов управления и настройки.
-
6.3 Подтверждение соответствия программного обеспечения.
При проведении поверки прибора выполняют операцию «Подтверждение соответствия программного обеспечения». Операция «Подтверждение соответствия программного обеспечения» состоит в определении номера версии (идентификационного номера) программного обеспечения.
Программное обеспечение запускается при нажатии на иконку «Rotor-Gene» на рабочем столе управляющего компьютера (прибор должен быть включен). Просмотр версии ПО доступен в разделе «О программе» пункта меню прибора «Справка».
Прибор считается прошедшим поверку, если номер версии СИ совпадает с номером версии или выше номера версии, указанного в описании типа.
-
6.4 Подготовка к анализу
-
6.4.1 Перед проведением поверки необходимо тщательно ознакомиться с руководством по эксплуатации и методикой поверки и выполнить следующие подготовительные работы:
-
-
♦ проверить наличие и срок годности стандартных образцов, реактивов и материалов;
-
♦ подготовить наборы реагентов в соответствии с их инструкциями по применению;
-
♦ подготовить и подписать 4 микропробирки (0,5 мл) для приготовления разбавлений калибратора (К54, К18, К16 и К2);
-
♦ подготовить и подписать микропробирки (0.2 мл) для проведения ПЦР, исходя из повторности 3 для 4-х концентраций ДНК калибратор К (по Табл. 3 - К54, К18, Кб и К2), повторности 5 для 2-х исследуемых образцов (И-1 и И-0,1), а также повторности 2 для положительного контрольного образца (ПКО) и отрицательного контрольного образца (ОКО);
-
♦ подготовить и подписать (CKO-1, СКО-2,..., CKO-10) 10 микропробирок (0,2 мл) для проведения ПЦР с целью определения СКО.
-
♦ подготовить охлаждаемый штатив или ледяную баню: во время проведения манипуляций СО и реактивы должны находиться при температуре не выше +4 °C, при проведении разбавления вода и образцы СО должны иметь одинаковую температуру!
-
6.4.2 Подготовить к анализу стандартные образцы следующим образом:
-
6.4.2.1 Хранившиеся при минус 20 °C и ниже исследуемые образцы СО разморозить при температуре 0 °C и тщательно перемешать, используя микроцентрифугу-вортекс (не менее 5 сек), сбросить капли кратким центрифугированием!
-
6.4.2.2 Перенести в новую микропробирку (К-54) 52 мкл образца ДНК ГМ-СОЯ-ВНИИМ-5.
-
6.4.2.3 Полученный по предыдущему пункту раствор для дальнейшего построения калибровочной прямой разбавить деионизированной водой, свободной от ДНКаз, в соответствие с таблицей 3.
-
ВАЖНО: после каждого разбавления - тщательно (не менее 5 с) перемешать на вортексе, сбросить капли кратковременным центрифугированием!
Таблица 3.
|
Исходная массовая концентрация ДНК, нг/мкл |
Объём раствора ДНК, мкл |
Объём деионизированной воды, мкл |
Итоговая массовая концентрация ДНК, нг/мкл |
|
54 |
20 |
40 |
18 |
|
18 |
20 |
40 |
6 |
|
6 |
20 |
40 |
2 |
-
6.4.2.4 В соответствии с инструкцией по применению набора реагентов для проведения полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) (Табл. 2) подготовить реакционную смесь:
-
6.4.2.4.1 Разморозить 4 пробирки с ПЦР-смесью-1-FRT ГМ соя (1 пробирка рассчитана на постановку 10 реакций) и 5 пробирок «Кст ГМ соя 1%». Перемешать на вортексе и сбросить капли с помощью кратковременного центрифугирования.
-
6.4.2.4.2 Для проведения 36 реакций смешать в отдельной пробирке 370 мкл ПЦР-смеси-1 - FRT ГМ соя, 185 мкл ПЦР-буфера-Flu и 18,5 мкл полимеразы (TaqF).
-
6.4.2.4.3 Перемешать смесь на вортексе, осадить кратковременным центрифугированием и внести по 15 мкл в соответствующие микропробирки подготовленные по п. 6.4.1 используя пипеточные дозаторы.
-
6.4.2.4.4 Используя наконечник с аэрозольным барьером в подготовленные подписанные пробирки добавить по 10 мкл ДНК исследуемых образцов в следующем порядке:
-
6.4.2.4.4.1 В микропробирки (К) с реакционной смесью (по 3 пробирки для каждого разведения) вносят по 10 мкл подготовленного по п. 6.4.2.2 и 6.4.2.3 раствора разбавлений калибранта 54 нг/мкл, 18 нг/мкл, 6 нг/мкл и 2 нг/мкл.
-
6.4.2.4.4.2 В микропробирки (И-1 и И-0,1) с реакционной смесью (по 5 пробирок для каждого образца) вносят по 10 мкл подготовленного по п. 6.4.2.4.4.1 раствора исследуемого образца (ГМ-СОЯ-ВНИИМ-1 - 30 нг/мкл, ГМ-СОЯ-ВНИИМ-0,1 - 30 нг/мкл).
-
6.4.2.4.4.3 В микропробирки (СКО-1, СКО-2, ..., СКО-10) с реакционной смесью вносят по 10 мкл «Кст ГМ соя 1%».
-
6.4.2.4.4.4 В микропробирки (ПКО) с реакционной смесью (2 пробирки) вносят по 10 мкл положительного контрольного образца.
-
-
6.4.24.4.5 В микропробирки (ОКО) с реакционной смесью (2 пробирки) вносят по 10 мкл ОКО.
6.5 Определение метрологических характеристик.
Определение относительной погрешности и относительного СКО случайной составляющей погрешности при измерении массовой доли ГМО сои методом ПЦР.
Включить прибор, подготовить его к работе в соответствии с РЭ. Подготовить поверочные растворы в соответствии с разделом 6.4, разместить ПЦР-пробирки в гнездах ротора. Запрограммировать прибор для выполнения соответствующей программы амплификации и детектирования флуоресцентного сигнала согласно инструкции к набору «АмплиКвант ГМ соя-FL» и провести ПЦР-реакцию в режиме реального времени (Приложение Б, п.п. «Программирование амплификатора»).
6.5.1 Получить значения Ct для всех образцов для обоих каналов, в соответствии с инструкцией к набору «АмплиКвант ГМ соя-FL» (Приложение Б, п.п. «Анализ результатов амплификации ЭК соя (эндогенного контроля) (канал.ЮE/Yellow)». «Анализ результатов амплификации промотора 35S (канал FAM/Green)»).
• Провести обработку данных с использованием программы OpenOfficeCalc или аналогичной (например, MS Excel):
Обработка данных канала Yellow-Joe для калибровочных образцов: Заполнить таблицу

где С - условная концентрация ДНК сои в соответствующем разведении раствора калибратора (К54 соответствует условной концентрации 540 нг/мкл.), lg(C) - десятичный логарифм условной концентрации, <Ct> - среднее значение Ct, полученное из Зх значений Ct для соответствующего разбавления калибратора.
• Построить график зависимости <Ct>(lg(C)), построить линию линейной регрессии методом наименьших квадратов. Внести параметры регрессионной прямой в отдельные ячейки. Вычислить значение эффективности амплификации по формуле
eff= io(-1/al> (1)
где al - тангенс угла наклона регрессионной прямой
Референс Калибровочный график
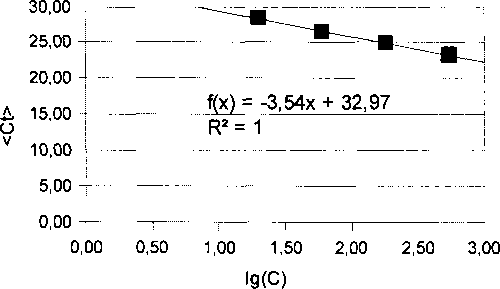
|
al |
bl |
|
-3,54 |
32,97 |
|
efficiency |
RA2 |
|
1,92 |
1 |
• Обработка данных канала Green-FAM для калибровочных образцов: Заполнить таблицу

|
27,00 |
143 |
|
9,00 |
0,95 |
|
3,00 |
0,48 |
|
1,00 |
0,00 |
7 где С - условная концентрация ДНК ГМ-сои в соответствующем разведении раствора калибратора (К54 соответствует условной концентрации 27 нг/мкл.), lg(C) - десятичный логарифм условной концентрации, <Ct> - среднее значение Ct, полученное из Зх значений Ct для соответствующего разбавления калибратора.
• Построить график зависимости <Ct>(lg(C)), построить линию линейной регрессии методом наименьших квадратов. Внести параметры регрессионной прямой в отдельные ячейки. Вычислить значение эффективности амплификации по формуле:
eff= 10(’1/а2) (2),
где а2 - тангенс угла наклона регрессионной прямой

0,00 0,20 0,40 0,60 0,80 1,00 1,20 1,40 1,60
|д(С)
|
а2 |
Ь2 |
|
-3,57 |
34,00 |
|
efficiency |
R2 |
|
1,90 |
1 |
Обработка данных для исследуемых образцов: Заполнить таблицы 4 и 5.
Таблица 4.
|
ГМ-СОЯ-ВНИИМ-1 |
ГМ-СОЯ-ВНИИМ-0,1 | ||
|
С1 |
С1 | ||
|
С2 |
С2 | ||
|
сз |
СЗ | ||
|
С4 |
С4 | ||
|
С5 |
С5 | ||
|
<С> |
<С> | ||
|
Относительная погрешность | |||
Таблица 5.
|
Кст ГМ соя 1% | |
|
С1 | |
|
С2 | |
|
СЗ | |
|
С4 | |
|
С5 | |
|
С6 | |
|
С7 | |
|
С8 | |
|
С9 | |
|
СЮ | |
|
<с> | |
Концентрация С1-С5 в ячейках Таблицы 4 (С1-С10 в таблице 5) вычисляется по формулам:
Cti(FAM) - Ь2 Cti(jQE)-bl
Ci = 1000*10
а2
al
(3)
где СИ - соответствующее значение Ct для исследуемого образца,
<С> - среднее значение концентрации в образцах:
<С> = (С1+С2+...+С4)/4 (4)
где i-номер образца из Таблицы 4
<С> = (С1+С2+...+С10)/10 (5)
где i-номер образца из Таблицы 5
Примечание. В случае, если чувствительность применяемой системы реагентов оказывается недостаточной и для образца ГМ-СОЯ-ВНИИМ-0,1, часть полученных результатов является выбросами, т.е. соответствующее значение Cti (FAM) для конкретных измерений не определяется прибором, то данные выбросы необходимо исключить из дальнейших расчетов (если выбросов не больше 2). В случае, если количество выбросов больше 2, следует повторить постановку ПЦР, обращая внимание на тщательное вымешивание растворов ДНК.
6.5.2 Расчет относительной погрешности. Относительная погрешность измерения массовой доли ДНК генетически модифицированной сои линии 40-3-2 в ДНК натуральной сои в СО ГМ-СОЯ-ВНИИМ-1 вычисляется по формуле:

Р
(6)
где Р - значение массовой доли ДНК генетически модифицированной сои линии 40-3-2 в ДНК натуральной сои в СО ГМ-СОЯ-ВНИИМ-1 по паспорту, <С> - среднее значение массовой доли ДНК генетически модифицированной сои линии 40-3-2 в ДНК натуральной сои в СО ГМ-СОЯ-ВНИИМ-1 измеренное. Результат вычислений заносится в протокол.
-
6.5.3 Относительное СКО случайной составляющей погрешности результата измерения значения массовой доли ДНК генетически модифицированной сои в «Кст ГМ 1%» вычисляется по формуле:
If (С, -<с»=
s = ~(c)rL—~9—х100% (7)где Ci - значение массовой доли ДНК генетически модифицированной сои рассчитанное по формуле 3 из данных в Таблице 5, <С> - среднее арифметическое массовой доли ДНК генетически модифицированной сои в повторности, вычисленное по формуле 5; i - номер образца. Результат вычислений заносится в протокол.
-
6.5.4 Результат построения калибровочных графиков считается положительным, если значения коэффициентов корреляции R2 составляют не менее 0,97.
-
6.5.5 Прибор считается прошедшим поверку по п. 6.5.2, если относительная погрешность определения массовой доли ДНК генетически модифицированной сои линии 40-3-2 в ДНК натуральной сои в образце ГМ-СОЯ-ВНИИМ-1 не превышает ±25 %.
-
6.5.6 Прибор считается прошедшим поверку по п. 6.5.3, если относительное СКО случайной составляющей погрешности определения массовой доли ДНК генетически модифицированной сои линии 40-3-2 в ДНК натуральной сои в образце ГМ-СОЯ-ВНИИМ-1 не превышает 15 %.
-
6.5.7 Прибор считается прошедшим поверку по п. 6.5.1., если полученное среднее значение содержания ГМ-сои в образце ГМ-СОЯ-ВНИИМ-0,1 лежит в пределах от 0.5 г/кг до 5 г/кг.
-
6.5.8 Проверка диапазона измерений при использовании ГСО 9866-2011 состава ДНК сои (КОМПЛЕКТ ГМ-СОЯ-ВНИИМ) проводится одновременно с определением погрешности прибора. Линейность калибровочного графика свидетельствует о корректной работе прибора в диапазоне измерений от 1 г/кг до 50 г/кг массовой доли ГМ ДНК к ДНК натуральной сои.
-
6.5.9 Прибор считается прошедшим поверку при положительных результатах проверки по п.п. 6.1 - 6.5.
-
7.1. При проведении поверки составляется протокол результатов измерений по форме Приложения Б.
-
7.2. Результаты поверки оформляют в виде свидетельства о поверке или извещения о непригодности.
-
7.3. Результаты поверки считаются положительными, если прибор удовлетворяет всем требованиям настоящей методики. Положительные результаты поверки оформляются путем выдачи свидетельства о поверке. Знак поверки рекомендуется наносить на свидетельство о поверке.
-
7.4. Результаты считаются отрицательными, если при проведении поверки установлено несоответствие поверяемого анализатора, хотя бы одному из требований настоящей методики. Отрицательные результаты поверки оформляются путем выдачи извещения о непригодности с указанием причин непригодности.
ПРИЛОЖЕНИЕ Б
ПРОТОКОЛ ПОВЕРКИ
№ от ХХ.ХХ.20ХХ г.
|
Наименование прибора, тип | |
|
Регистрационный номер в Федеральном информационном фонде по обеспечению единства измерений (ОЕИ) | |
|
Заводской номер (если имеется информация) | |
|
Изготовитель (если имеется информация) | |
|
Год выпуска (если имеется информация) | |
|
Заказчик (наименование и адрес) | |
|
Серия и номер знака предыдущей поверки (если такие имеются) |
Вид поверки_____________________________________________________________
Методика поверки______________________________________________________
Средства поверки:
|
Наименование и регистрационный номер эталона, тип СИ, заводской номер, номер паспорта на ГСО |
Метрологические характеристики, срок годности ГСО |
Условия поверки:
|
Параметры |
Требования НД |
Измеренные значения |
|
Температура окружающего воздуха, °C |
от 18 до 30 | |
|
Относительная влажность воздуха, % |
от 30 до 80 | |
|
Атмосферное давление, кПа |
от 84,0 до 106,7 |
Результаты поверки:
-
1. Внешний осмотр____________________________________________________________
-
2. Опробование_________________________________________________________________
-
3. Определение метрологических характеристик (в соответствии с требованиями НД на методы и средства поверки)
Наименование параметра/ единица измерений
Максимальное значение относительной погрешности, полученное при поверке
Предел допускаемой относительной погрешности
Максимальное значение относительного СКО случайной составляющей погрешности. полученное при поверке
Предел допускаемого значение относительного СКО случайной составляющей погрешности
Массовая доля ДНК генетически модифицирование й сои линии 40-3- 2 в ДНК натуральной сои (ГМ-СОЯ ВНИИМ 1)/ г/кг
25 %
15%
4. Дополнительная информация (состояние объекта поверки, сведения о ремонте, юстировке)_______________________________________________________________________________
На основании результатов поверки выдано:
свидетельство о поверке №_________________________от___________________________
Поверку произвел_______________________________от__
ФИО
Подпись
Дата


