№2408 от 27.06.2010
Приказ Федерального агентства по техническому регулированию и метрологии (Росстандарт)
# 22918
Об утверждении Перечня документов в области стандартизации, в результате применения которых на добровольной основе обеспечивается соблюдение требований технического регламента "О требованиях безопасности крови, ее продуктов, кровезамещающих растворов и технических средств, используемых в трансфузионно-инфузионной терапии", утвержденного постановлением Правительства Российской Федерации от 26 января 2010г. №29
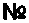
2408
28 июня 2010 г.
г. Москва
Об утверждении Перечня документов в области стандартизации, в результате применения которых на добровольной основе обеспечивается соблюдение требований технического регламента «О требованиях безопасности крови, ее продуктов, кровезамещающих растворов и технических средств, используемых в трансфузионно-инфузионной терапии», утвержденного постановлением Правительства Российской Федерации от 26 января 2010 г. № 29
В целях обеспечения выполнения положений статьи 16-1. Федерального закона от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании» и постановления Правительства Российской Федерации от 26 января 2010 г. №29 приказываю:
-
1. Утвердить прилагаемый Перечень документов в области стандартизации, в результате применения которых на добровольной основе обеспечивается соблюдение требований технического регламента «О требованиях безопасности крови, ее продуктов, кровезамещающих растворов и технических средств, используемых в трансфузионно-инфузионной терапии», утвержденного постановлением Правительства Российской Федерации от 26 января 2010 г. № 29.
-
2. Контроль за исполнением настоящего приказа возложить на заместителя
Руководителя Федерального агентства А.В. Зажигалкина.
Руководитель Федерального агентства
Г.И. Элькин
УТВЕРЖДЕН
приказом Федерального агентства по техническому регулированию и метрологии
ОТ 28.06.2010 г. № 2408
Перечень документов в области стандартизации, в результате применения которых на добровольной основе обеспечивается соблюдение требований технического регламента «О требованиях безопасности крови, ее продуктов, кровезамещающих растворов и технических средств, используемых в трансфузионно-инфузионной терапии», утвержденного постановлением Правительства Российской Федерации от 26 января 2010 г. № 29
|
Обозначение национального стандарта |
Наименование национального стандарта |
|
1 |
2 |
|
ГОСТ Р 52938-2008 |
Кровь донорская и ее компоненты. Контейнеры с консервированной кровью или ее компонентами. Маркировка |
|
ГОСТ Р 53420-2009 (с 01.09.2010) |
Кровь донорская и ее компоненты. Общие требования к обеспечению качества при заготовке, переработке, хранении и использовании донорской крови и ее компонентов |
|
ГОСТ Р 53470-2009 (с 01.09.2010) |
Кровь донорская и ее компоненты. Руководство по применению компонентов донорской крови |
|
ГОСТРИСО 6710-2009 (с 01.03.2010) |
Контейнеры для сбора образцов венозной крови одноразовые. Технические требования и методы испытаний |
|
ГОСТ Р 50855-96 |
Контейнеры для крови и ее компонентов. Требования химической и биологической безопасности и методы испытаний |
|
ГОСТ Р 51622-2000 (ИСО 3826-93) |
Контейнеры полимерные для крови и ее компонентов однократного применения. Технические требования. Методы испытаний |
|
ГОСТ 10782-85 |
Бутылки стеклянные для крови, трансфузионных и инфузионных препаратов. Технические условия |
|
ГОСТ 22967-90 |
Шприцы медицинские инъекционные многократного применения. Общие технические требования и методы испытаний |
|
ГОСТ 24861-91 (ИСО 7886-84) (до 01.09.2010) ГОСТ Р ИСО 7886-1-2009 (с 01.09.2010) |
—------—--■--—------------ --“1 Шприцы инъекционные однократного применения Шприцы инъекционные однократного применения стерильные. Часть 1. Шприцы для ручного использования |
|
ГОСТ Р ИСО 78886-3-2009 (С 01.01.2011) |
Шприцы инъекционные однократного применения стерильные. Часть 3. Шприцы для иммунизации фиксированной дозой, автоматически приходящие в негодность после применения |
|
ГОСТ Р ИОС 7886-4-2009 (c01.01.2011) |
Шприцы инъекционные однократного применения стерильные. Часть 4. Шприцы с устройством, препятствующим их повторному применению |
|
ГОСТ 25046-81 (до 01.09.2010) ГОСТ Р ИСО 7864-2009 (с 01.09.2010) |
Иглы инъекционные однократного применения. Основные размеры. Технические требования. Методы испытаний Иглы инъекционные однократного применения стерильные |
|
ГОСТ 25377-82 |
Иглы инъекционные многократного применения. Технические условия |
|
ГОСТ 25047-87 |
Устройства комплектные эксфузионные, инфузионные и трансфузионные однократного применения. Технические условия |
|
ГОСТ Р ИСО 10555.1-99 |
Катетеры внутрисосудистые стерильные однократного применения. Часть 1. Общие технические требования |
|
ГОСТ Р ИСО 10555.2-99 |
Катетеры внутрисосудистые стерильные однократного применения. Часть 2. Катетеры ангиографические |
|
ГОСТ Р ИСО 10555.3-99 |
Катетеры внутрисосудистые стерильные однократного применения. Часть 3. Катетеры венозные центральные |
|
ГОСТ Р ИСО 10555.4-99 |
Катетеры внутрисосудистые стерильные однократного применения. Часть 4. Катетеры для баллонного расширения |
|
ГОСТ Р ИСО 10555.5-99 |
Катетеры внутрисосудистые стерильные однократного применения. Часть 5. Катетеры периферические с внутренней иглой |
|
ГОСТ Р ИСО 10993.1-99 (до 01.07.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования |
|
ГОСТ Р ИСО 10993.3-99 (до 01.07.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 3. Исследование генотоксичности, канцерогенности и токсического действия на репродуктивную функцию |
|
ГОСТР ИСО 10993.4-99 (до 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 4. Исследование изделий, взаимодействующих с кровью |
|
ГОСТР ИСО 10993.5-99 (до 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследование на цитотоксичность: методы in vitro |
|
ГОСТР ИСО 10993.6-99 (до 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 6. Исследование местного действия после имплантации |
|
ГОСТР ИСО 10993.7-99 (до 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание этиленоксида после стерилизации |
|
ГОСТР ИСО 10993.9-99 (до 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 9. Основные принципы идентификации и количественного определения потенциальных продуктов деструкции |
|
ГОСТ Р ИСО 10993.10-99 (до 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 10. Исследование раздражающего и сенсибилизирующего действия |
|
ГОСТР ИСО 10993.11-99 (до 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 11. Исследование общетоксического действия |
|
ГОСТР ИСО 10993.12-99 (до 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и стандартные образцы |
|
ГОСТР ИСО 10993.13-99 (до 01.07.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 13. Идентификация и количественное определение продуктов деструкции полимерных медицинских изделий |
|
ГОСТР ИСО 10993-14- 2001 (до 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 14. Идентификация и количественное определение продуктов деструкции керамики |
|
ГОСТР ИСО 10993-15- 2001 (до 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 15. Идентификация и количественное определение продуктов деструкции металлов и сплавов |
|
ГОСТР ИСО 10993.16-99 (до 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 16. Моделирование и исследование токсикокинетики продуктов деструкции и вымывания |
|
ГОСТРИСО 10993-1- 2009 (с 01.07.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования |
|
ГОСТРИСО 10993-3- 2009 (с 01.07.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 3. Исследование генотоксичности, канцерогенности и токсического действия на репродуктивную функцию |
|
ГОСТРИСО 10993-4- 2009 (с 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 4. Исследования изделий, взаимодействующих с кровью |
|
ГОСТР ИСО 10993-5- 2009 (с 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследования на цитотоксичность; методы in vitro |
|
ГОСТРИСО 10993-6- 2009 (с 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 6. Исследования местного действия после имплантации |
|
ГОСТРИСО 10993-7- 2009 (с 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание этилен оксида после стерилизации |
|
ГОСТРИСО 10993-9- 2009 (с 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 9. Основные принципы идентификации и количественного определения потенциальных продуктов деградации |
|
ГОСТРИСО 10993-10- 2009 (с 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 10. Исследования раздражающего и сенсибилизирующего действия |
|
ГОСТРИСО 10993-11- 2009 (с 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 11. Исследования общетоксического действия |
|
ГОСТРИСО 10993-12- 2009 (с 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и стандартные образцы |
|
ГОСТРИСО 10993-13- 2009 (с 01.07.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 13. Идентификация и количественное определение продуктов деградации полимерных медицинских изделий |
|
ГОСТРИСО 10993-14- 2009 (с 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 14. Идентификация и количественное определение продуктов деградации изделий из керамики |
|
ГОСТРИСО 10993-15- 2009 (с 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 15. Идентификация и количественное определение продуктов деградации изделий из металлов и сплавов |
|
ГОСТР ИСО 10993-16- 2009 (с 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 16. Моделирование и исследование токсикокинетики продуктов деструкции и вымывания |
|
ГОСТРИСО 10993-17- 2009 (с 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 17. Установление пороговых значений для вымываемых веществ |
|
ГОСТРИСО 10993-18- 2009 (с 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 18. Исследование химических свойств материалов |
|
ГОСТРИСО/ТС 10993- 19-2009 (с 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 19. Исследования физико-химических, морфологических и топографических свойств материалов |
|
ГОСТРИСО/ТС 10993- 20-2009 (с 01.09.2010) |
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 20. Принципы и методы исследования иммунотоксичности медицинских изделий |
|
ГОСТР 51148-98 |
Изделия медицинские. Требования к образцам и документации, представляемым на токсикологические, санитарно-химические испытания, испытания па стерильность и пирогенность |
|
ГОСТР 52770-2007 |
Изделия медицинские. Требования безопасности. Методы санитарно-химических и токсикологических испытаний |
|
ГОСТР 51609-2000 |
Изделия медицинские. Классификация в зависимости от потенциального риска применения. Общие требования |
|
ГОСТРИСО 14971-2006 |
Изделия медицинские. Применение менеджмента риска к медицинским изделиям |
|
ГОСТ Р ИСО 13485-2004 |
Изделия медицинские. Системы менеджмента качества. Системные требования для целей регулирования |
|
ГОСТРИСО/ТО 14969- 2007 _ |
Изделия медицинские. Системы менеджмента качества. Руководство по применению ISO 13485-2003 |
|
ГострИСО/ТО 16142- 2008 |
Изделия медицинские. Руководство по выбору стандартов, поддерживающих важнейшие принципы обеспечения безопасности и эксплуатационных характеристик медицинских изделий |
|
ГОСТРИСО 15223-2002 |
Медицинские изделия. Символы, применяемые при маркировании на медицинских изделиях, этикетках и в сопроводительной документации |
|
ГОСТРИСО 17511-2006 i |
Изделия медицинские для диагностики in vitro. Измерение величин в биологических пробах. Метрологическая прослеживаемость значений, приписанных калибраторам и контрольным материалам |
|
ГОСТРИСО 18153-2006 |
Изделия медицинские для диагностики in vitro. Измерение величин в биологических пробах. Метрологическая прослеживаемость значений каталитической концентрации ферментов, приписанных калибраторам и контрольным материалам. |
|
ГОСТРИСО 15194-2007 |
Изделия для диагностики in vitro. Измерение величин в пробах биологического происхождения. Описание стандартных образцов |
|
ГОСТРИСО 17593-2009 (с 01.09.2010) |
Клинические лабораторные исследования и изделия медицинские in vitro. Требования к системам мониторинга in vitro для самотестирования при перероральной терапии антикоагулянтами |
|
ГОСТР ИСО 15197-2009 (с 01.09.2010) |
Системы диагностические in vitro. Требования к системам мониторного наблюдения за концентрацией глюкозы в крови для самоконтроля при лечении сахарного диабета |
|
ГОСТРИСО 15198-2009 (с 01.09.2010) |
Клиническая лабораторная медицина. Изделия медицинские для диагностики in vitro. Подтверждение методик контроля качества, рекомендуемых изготовителями пользователям |
|
ГОСТ Р ИСО 15193-2007 |
Изделия для диагностики in vitro. Измерение величин в пробах биологического происхождения. Описание референтных методик выполнения измерений |
|
ГОСТ Р ИСО 22870-2009 (с 01.09.2010) |
Исследования по месту лечения. Требования к качеству и компетентности |
|
ГОСТРИСО 15189-2006 (до 01.09.2010) |
Лаборатории медицинские. Специальные требования к качеству и компетентности |
|
ГОСТ Р ИСО/ТО 22869- 2009 (с 01.07.2010) |
Лаборатории медицинские. Руководство по внедрению ИСО 15189:2003 |
|
ГОСТРИСО 15195-2006 |
Лабораторная медицина. Требования к лабораториям референтных измерений |
|
ГОСТ Р 52905-2007 (ИСО 15190:2003) |
Лаборатории медицинские. Требования безопасности |
|
ГОСТ Р 53022.1-2008 |
Технологии лабораторные клинические. Требования к качеству клинических лабораторных исследований. Часть 1. Правила менеджмента качества клинических лабораторных исследований |
|
ГОСТР 53022.2-2008 |
Технологии лабораторные клинические. Требования к качеству клинических лабораторных исследований. Часть 2. Оценка аналитической надежности методов исследования (точность, чувствительность, специфичность) |
|
ГОСТ Р 53022.3-2008 |
Технологии лабораторные клинические. Требования к качеству клинических лабораторных исследований. Часть 3. Правила Оценки клинической информативности лабораторных тестов |
|
ГОСТР 53022.4-2008 |
Технологии лабораторные клинические. Требования к качеству клинических лабораторных исследований. Часть 4. Правила разработки требований к своевременности предоставления лабораторной информации |
|
ГОСТР 53079.1-2008 |
Технологии лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть 1. Правила описания методов исследования |
|
ГОСТ Р 53079.2-2008 |
Технологии лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть 2. Руководство по управлению качеством в клинико-диагностической лаборатории. Типовая модель |
|
ГОСТ Р 53079.3-2008 |
Технологии лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть 3. Правила взаимодействия персонала клинических подразделений и клинико-диагностических лабораторий медицинских организаций при выполнении клинических лабораторных исследований |
|
ГОСТР 53079.4-2008 |
Технологии лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть 4. Правила ведения преаналитического этапа |



